乌兹别克斯坦医疗器械和体外诊断试剂(IVD)注册认证法规要求介绍
一、乌兹别克斯坦医疗器械基本情况
乌兹别克斯坦医疗器械由乌兹卫生部下属国家中心监督管理。注册过程中涉及到国家中心的如下部门:国家中心注册部门,国家中心实验室,创新医疗技术委员会以及专家委员会。
用于临床前及临床研究,展览会、交易会、国际论坛上展出的进口医疗器械以及注册样品,均无需注册,但是要获得卫生部的声明函,才可办理进口许可。其他医疗器械产品均需要注册后才能进入乌兹境内。
二、乌兹别克斯坦医疗器械注册程序简介
注册程序和注册周期:
乌兹别克斯坦医疗器械有以下两种注册程序供申请人选择:
1、完整注册,需在乌兹本地做实验室测试和临床评估,注册周期自递交之日算起一般为8-10个月。
2、认可注册,针对获得欧盟/美国/日本/韩国/英国证书的产品,认可程序不需要本地实验室测试和临床评估,注册周期自递交之日算起一般为2-3个月。
注册流程、预估费用和注意事项:
详见下图,

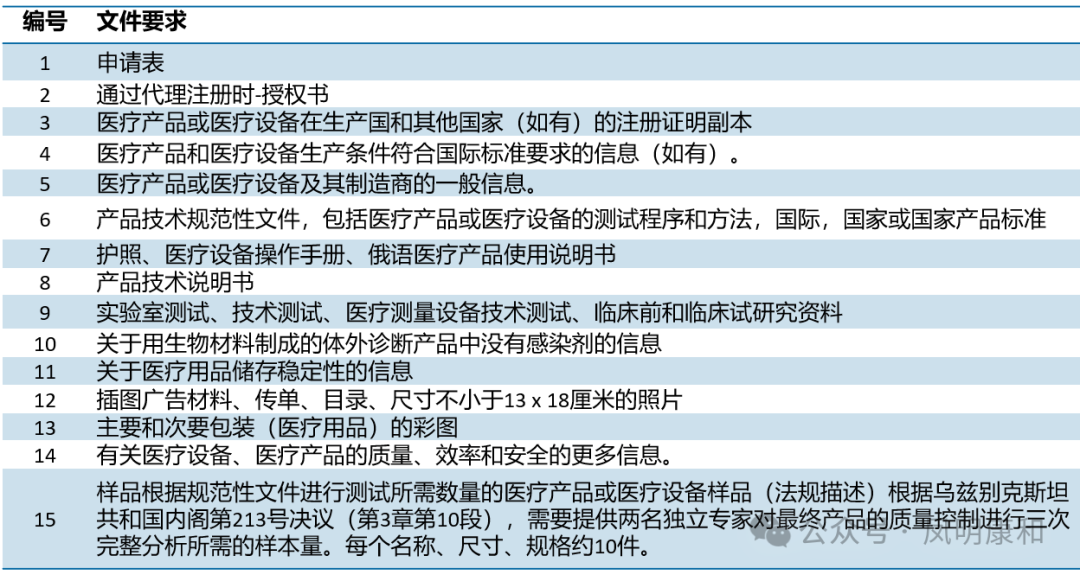
三、注册资料清单(首次)
注册资料及样品要求见下表,认可程序与完整程序的资料要求基本一致(编号1-14),样品要求(编号15)因认可程序无需实验室测试与认可程序不同。
四、注册证书样式
乌兹别克斯坦医疗器械注册证书的有效期为5年。批准后,若产品不发生任何变化,则不需对注册证书进行变更维护。注册证书样稿如下图所示:

创建时间:2024-05-11 11:40

