乌克兰医疗器械和体外诊断试剂(IVD)注册认证法规要求介绍
一、乌克兰医疗器械法规系统框架简介
乌克兰医疗器械注册与欧盟的模式类似,除Ⅰ类非无菌无测量功能的医疗器械外,医疗器械的注册均由乌克兰国家指定的评定机构(相当于欧盟的认证机构)执行。
二、乌克兰医疗器械注册程序简介
乌克兰医疗器械有以下四种注册程序供申请人选择:
1、自我声明(DOC)程序:
适用于Ⅰ类非无菌、无测量功能的医疗器械,该程序不需评定机构的审查和批准,由申请人自负责任发布符合技术法规要求的合格声明。
2、标准程序:
标准程序适用于Ⅰ类无菌、有测量功能的医疗器械、Ⅱa、Ⅱb和Ⅲ类医疗器械,该程序需要评定机构对申报产品的注册资料实施审查和批准,需要现场审查(验厂)。标准程序批准后的注册证书有效期为5年。
注册周期:标准程序的注册周期自递交之日起一般为5-7个月。
注册流程、预估费用和注意事项:详见下图所示,

注:现场审查(验厂)因疫情原因自2020年4月起可远程视频审查。
3、欧盟认证认可程序(Recognition of the EU Certificate)
适用于已获欧盟批准的医疗器械产品,该程序无需现场审查,但证书批准后需要对制造商实行强制性年审。
欧盟认证认可程序具有时间短、费用低的优点。
注册周期:欧盟认证认可程序的注册周期自递交之日起一般为3-4个月。
注册流程、预估费用和注意事项:详见上图(标准程序)所示。
4. 批次认证(Batch Certification)程序:
适用于不经常进口、不能通过标准程序或不能通过欧盟认证认可程序获批的医疗器械。不适用于无菌医疗器械、多型号医疗器械(型号多测试成本多)和重型设备(测试困难)等。
程序通过对特定批次医疗器械进行实验室测试和文件评估结果签发的证书,仅针对特定批次产品有效。
5. 其它认证
除以上1-4种注册程序外,申报产品若有适用的非医疗器械法规,如RoHS2法规(电子电气设备)和RED法规(无线电通信功能(如蓝牙))等,也需要依据相应法规程序获得批准。
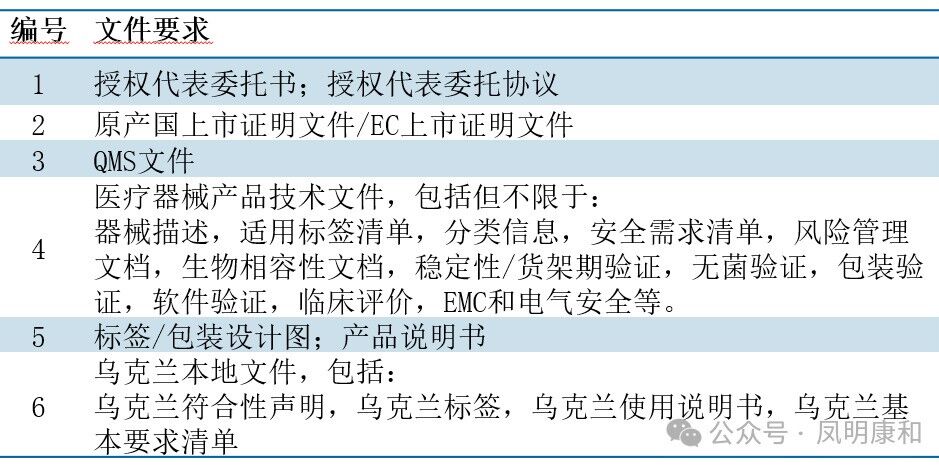
三、注册资料清单(首次)
四、注册证书样式


